2024年10月31日,苹果版bd
医学部助理教授李国锋与中山大学教授洪亮、教授李民等合作,在美国化学会药物化学权威期刊Journal of Medicinal Chemistry上发表题为“Design, synthesis and activity evaluation of BRD4 PROTAC based on alkenyl oxindole-DCAF11 pair”的研究论文。一种基于双荧光报告细胞系的高内涵筛选策略,成功实现了蛋白靶向嵌合体(PROTAC)的快速筛选。此外,研究进一步证实了烯基氧化吲哚与E3泛素连接酶DCAF11在PROTAC设计中的互配关系。这一发现对新型E3泛素连接酶配体的发现与应用具有重要的推动意义。苹果版bd
医学部博士后赵漫,硕士研究生马文静、梁锦怡为该研究的共同第一作者。

靶向蛋白降解(TPD)是一种新兴的治疗策略,通过诱导不可成药蛋白的降解从而达到治疗目的,其中最具代表性的PROTAC分子备受关注并已进入临床研究阶段,表明了PROTAC的应用潜力。然而,逐渐显现的耐药性及PROTAC活性鉴定的低效性限制了PROTAC的快速发展。因此,开发有效的高通量筛选策略对PROTAC的发展具有重要意义。
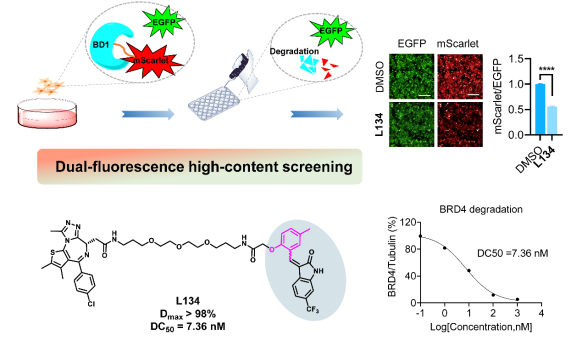
该研究团队在先前研究的基础上(PLOS Biol.2024,22, e3002550),新设计合成了一系列基于烯基氧化吲哚结构的BRD4-PROTAC先导化合物。采用mScarlet/ EGFP的双荧光报告细胞系,结合细胞高内涵成像技术,实现了细胞中靶蛋白降解效率的高通量高效率评估。通过这种高通量筛选策略,该团队筛选获得了一种强效的BRD4-PROTAC先导化合物L134(Dmax> 98%, DC50= 7.36 nM)。L134不仅能显著抑制多种乳腺癌细胞的增殖,还可抑制乳腺癌细胞迁移并诱导细胞凋亡,表明了L134的抗乳腺癌潜力。
这一研究成果不仅证实了基于高内涵的高通量靶向蛋白质降解筛选的有效性,也进一步证实了烯基氧化吲哚与DCAF11在蛋白降解中的应用潜力,为靶向蛋白质降解药物的研发和应用提供了有价值的借鉴。
该研究得到了国家自然科学基金委等项目的支持。
原文链接:https://doi.org/10.1021/acs.jmedchem.4c01767





